 Design for ATP strekker seg utover rotasjonsmotoren
Design for ATP strekker seg utover rotasjonsmotoren
Evolusjonsnyheter; 21. august 2019
Oversatt herfra.
Bilde 1: En scene fra 'ATP Synthase: Power Power of the Cell' , via Discovery Institute.
Som Michael Behe sier i Darwin Devolves -her, er bakterieflagellen, ikonet av ikke-reduserbar kompleksitet - som aldri er forklart med en darwinistisk prosess - en av to roterende motorer som finnes i celler. Den andre er ATP synthase, et annet ikon for intelligent design. Tre nye artikler denne måneden finner flere ting om den til å beundre. Som en introduksjon, se animasjonen vår-her.
Effektivitets-ekspert
En artikkel i PNAS av Kwangho Nam og Martin Karplus utforsker "Innblikk i opprinnelsen til høy energiomsetnings-effektiviteten til F1 -ATPase." Og gjett om de mener effektivitet!
 --F1 -ATPase er et lite motor protein, sammensatt av 3 alpha- og 3 beta -underenheter som omgir en sentral gamma -underenhet. P-underenhetene veksler syklisk mellom to hovedkonformasjons-tilstander for å produsere rotasjonen til y-underenheten. Selv om rotasjonen på mikrosekunds tidsskala drives av den differensielle bindingen av ATP og dens hydrolyseprodukter ADP og
--F1 -ATPase er et lite motor protein, sammensatt av 3 alpha- og 3 beta -underenheter som omgir en sentral gamma -underenhet. P-underenhetene veksler syklisk mellom to hovedkonformasjons-tilstander for å produsere rotasjonen til y-underenheten. Selv om rotasjonen på mikrosekunds tidsskala drives av den differensielle bindingen av ATP og dens hydrolyseprodukter ADP og  , er det nesten 100% konverteringseffektivitet for den frie energien til ATP-hydrolyse, som forekommer på piko-sekunds tidsskala. Den frie energiprofilen, konstruert for 360
, er det nesten 100% konverteringseffektivitet for den frie energien til ATP-hydrolyse, som forekommer på piko-sekunds tidsskala. Den frie energiprofilen, konstruert for 360 rotasjonssyklusen, viser at F1-ATPase oppnår sin høye energi-konverteringseffektivitet ved elegant å separere raske katalytiske hendelser, som involverer små lokale konformasjonsendringer, fra den langsomme binding/frigjøring av ligander -her involvert i stor konformasjonsendring. [Vekt og kursiv lagt til.]
rotasjonssyklusen, viser at F1-ATPase oppnår sin høye energi-konverteringseffektivitet ved elegant å separere raske katalytiske hendelser, som involverer små lokale konformasjonsendringer, fra den langsomme binding/frigjøring av ligander -her involvert i stor konformasjonsendring. [Vekt og kursiv lagt til.]
Mange lærer i fysikk at 100 prosent effektivitet er uoppnåelig i energiforvandlingsprosesser. En teoretisk ideell Carnot-motor mister alltid betydelig energi til varme, og kan bare håpe på kanskje 64 prosent effektivitet (Penn State). Hvordan kan ATP-syntase oppnå effektivitet på nesten 100%, slik at energien fra en prosess konverteres fullstendig til en annen, med nesten null tap? Termisk flukt er for rask til å overvinnes, selv i denne skalaen.
Nesten null tap
Forfatterne fant et 'elegant skille' mellom to katalytiske hendelser som opererer i tidsskalaer som var forskjellige med seks størrelsesordener. Dette gir tilsynelatende motoren tid for 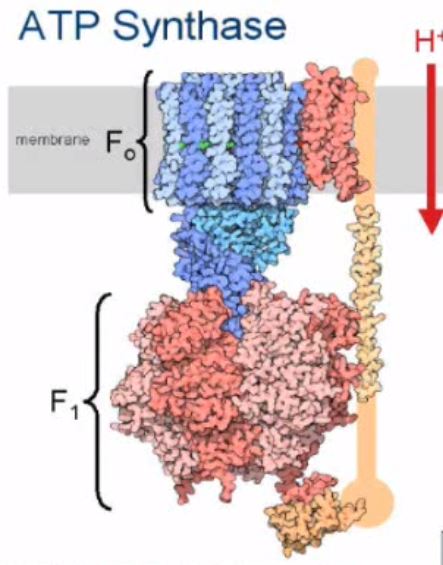 konformasjonsendringer i proteindelene og frigjøring av produkter som driver rotasjon av rotoren. Elastisiteten eller 'stivheten' i rotoren bidrar også til effektiv energiomsetning. Så finstemt er hver del av motoren i forhold til de andre, at den frie energien 'endres lineært langs rotasjonskoordinaten.' Dette betyr at motoren 'fungerer nær maksimal mulig effektivitet.'
konformasjonsendringer i proteindelene og frigjøring av produkter som driver rotasjon av rotoren. Elastisiteten eller 'stivheten' i rotoren bidrar også til effektiv energiomsetning. Så finstemt er hver del av motoren i forhold til de andre, at den frie energien 'endres lineært langs rotasjonskoordinaten.' Dette betyr at motoren 'fungerer nær maksimal mulig effektivitet.'
I motorene vi er kjent med, for eksempel bilmotorer, øker effektiviteten med temperaturen. Derimot drives ATP-syntese med minimalt varmetap hos både arktisk fisk som lever i nærheten av frysepunktet og i termofile bakterier som lever ved kokepunktet. Hvis menneskelige ingeniører kunne bygge bilmotorer med deler som bøyer seg litt, i stedet for å bruke klumpete metallstempler og stenger, ville de kanskje se tilsvarende økning i effektiviteten. Men det er tvilsomt om slike deler vil kunne drives like raskt eller vare like lenge som proteinene i ATP-syntase.
Hvor fort?
En beskrivelse i BioArchitecture -her sier: "Bakterieenzymer har blitt klokket til å gå opp til 42.000 o/min under lav belastning, selv om antallet enzymer under fysiologiske forhold er nærmere 6000 o/min." En typisk bil begynner å bli rødglødende ved den verdien. Høytytende racerbiler topper litt over 10 000 o/min. Er det ikke utrolig hva tilfeldigheter kan gjøre?
--Molekylære maskiner, som de roterende ATPasene som er beskrevet her, ser ut til å ha mye til felles med menneskeskapte maskiner. Imidlertid er analogiene bare til et visst punkt og er i store deler ikke helt forstått. Det som er tydelig er at flere milliarder år med evolusjon har resultert i biologiske motorer som ikke blir overgått i effektivitet, finjustering til miljø og bærekraft. Å forstå deres detaljerte funksjoner på molekylært nivå er ikke bare viktig for å tilfredsstille nysgjerrigheten vår, men vil helt sikkert ha implikasjoner for forståelsen av menneskets fysiologi, inkludert mitokondrielle lidelser, bioenergetikk og aldringsprosessene, samt påvirke nano-engineering og mange andre felt langt fremme.
Fleksibelt team
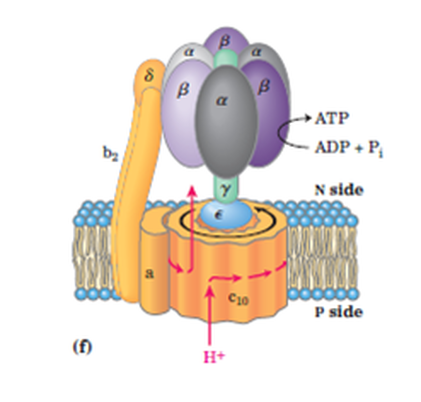
 Den første artikkelen dreide seg først og fremst om F1-delen av ATP-syntase, der ATP-syntese eller hydrolyse forekommer. F0- delen, der protoner driver rotasjon av et karuselllignende hjul, bidrar også til effektiviteten. Den driver y-underenheten som fungerer som en kamaksel. Akselen strekker seg inn i F1- delen, og 'snapper' effektivt ADP og fosfat sammen for å danne ATP i tre trinn per omdreining: syntese, utstøting og lastning. Et papir av Murphy et al. i Nature-her utforsker fleksibiliteten i y-underenheten som bidrar til effektiviteten i denne 'velsmurte maskinen'.
Den første artikkelen dreide seg først og fremst om F1-delen av ATP-syntase, der ATP-syntese eller hydrolyse forekommer. F0- delen, der protoner driver rotasjon av et karuselllignende hjul, bidrar også til effektiviteten. Den driver y-underenheten som fungerer som en kamaksel. Akselen strekker seg inn i F1- delen, og 'snapper' effektivt ADP og fosfat sammen for å danne ATP i tre trinn per omdreining: syntese, utstøting og lastning. Et papir av Murphy et al. i Nature-her utforsker fleksibiliteten i y-underenheten som bidrar til effektiviteten i denne 'velsmurte maskinen'.
Biofysikere har lenge lurt på et tilsynelatende misforhold mellom motorene F0 og F1. F0- karusellen er vanligvis sammensatt av 8 til 17 c-underenheter, avhengig av art, men F1-syntese-domenet har seks deler arrangert i par. Hvorfor ikke-heltall-forholdet mellom domenene? Fleksibilitet i y-underenheten tar seg av noe av misforholdet ved å lagre elastisk energi, men vil virke sløsende under kontinuerlig rotasjon. Murphy et al. la merke til at F1- domenet faktisk tar opp noe av slakken ved å rotere selv. Åpningskommentaren forklarer:
--De løste høyoppløselig kryo-elektronmikroskop-strukturer av ATP-syntase-komplekset, og trekker ut 13 rotasjons under-tilstander. Denne samlingen av strukturer avslørte at rotasjonen av F0- ringen og den sentrale stilken er koblet med delvis rotasjon av F1-hodet. Denne fleksibiliteten kan gjøre det mulig for hodet bedre å koble sammenhengende rotasjon med separate ATP-syntesehendelser.
En animasjon i artikkelen viser at F1-domenet gjennomgår en gyngende bevegelse frem og tilbake når Fo- domenet roterer rundt kontinuerlig. Vippebevegelsen oppnås ved hjelp av et annet finstemt protein kalt OSCP. Det fine med denne løsningen gjør det mulig for F1- hodet å tilpasse forskjellige størrelser på F0- rotorer gjennom et universalledd.
 Vi finner at F 1- hodet roterer sammen med den sentrale stangen og c-ringen gjennom omtrent 30
Vi finner at F 1- hodet roterer sammen med den sentrale stangen og c-ringen gjennom omtrent 30 , eller en c-underenhet, i begynnelsen av hvert 120
, eller en c-underenhet, i begynnelsen av hvert 120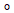 -trinn. Fleksibel kobling av F1-hodet til F0- motoren formidles først og fremst av et hengsel ved felles domene-koblingen til oligomycin-følsomhetsoverførende protein (OSCP) underenhet som forbinder F1- hodet til den perifere stangen. Den utvidede to-helix-bunten av den sentrale y-stang-underenheten samhandler med tilfang-sløyfeområdet til en beta-underenhet i F1-hodet. Den resulterende mekanismen for fleksibel kobling vil sannsynligvis bli bevart i andre F1 -F0 ATP-syntaser. Resultatene våre gir sårt tiltrengt kontekst til et hav av publiserte data som indikerer at OSCP er et nav for metabolsk kontroll i cellen.
-trinn. Fleksibel kobling av F1-hodet til F0- motoren formidles først og fremst av et hengsel ved felles domene-koblingen til oligomycin-følsomhetsoverførende protein (OSCP) underenhet som forbinder F1- hodet til den perifere stangen. Den utvidede to-helix-bunten av den sentrale y-stang-underenheten samhandler med tilfang-sløyfeområdet til en beta-underenhet i F1-hodet. Den resulterende mekanismen for fleksibel kobling vil sannsynligvis bli bevart i andre F1 -F0 ATP-syntaser. Resultatene våre gir sårt tiltrengt kontekst til et hav av publiserte data som indikerer at OSCP er et nav for metabolsk kontroll i cellen.
Forfatterne konkluderer med:
--I ATP-syntaser kan F1- katalytisk hode følge rotoren gjennom en rotasjon på ca. 30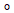 i begynnelsen av hvert ca. 120
i begynnelsen av hvert ca. 120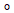 trinn. Denne bevegelsen tillater fleksibel kobling av F1 og F0. Interdomene-hengslet til OSCP letter fleksibel kobling og gjør denne underenheten til et passende punkt for regulering av ATP-syntese.
trinn. Denne bevegelsen tillater fleksibel kobling av F1 og F0. Interdomene-hengslet til OSCP letter fleksibel kobling og gjør denne underenheten til et passende punkt for regulering av ATP-syntese.
Tilstrekkelig betyr 'passende; velegnet; relevant; aktuell'. Hvor passende ordvalg, faktisk!
Hvor ATP går etter syntesen
Noen animasjoner av ATP-syntese viser produktene som strømmer ut fra maskinen, som om de bare flyr ut i luften. Faktisk er transport av ADP inn og ATP ut av motoren også tett regulert. Den 'mitokondriske ADP/ATP-Transportøren' (AAT) er der, som en UPS-lastebil, for å få produktene dit de trengs.
 Inne i mitokondrion, som rapportert her før , er det indre og ytre membraner, med TIM- og TOM-transportører som kontrollerer hva som kommer inn og kommer ut. I en annen artikkel i Nature , Bertholet et al. fant ut at AAC-transportproteiner har mer å gjøre enn bare å levere varer -her. De hjelper faktisk med å regulere hvor mange produkter som blir laget. Husk på følgende at H+ er et proton, 'drivstoffet' i proton-bevegelses kraften som driver F0 rotasjon i ATP-syntase. Protoner er ment å holde seg i den indre mitokondrielle membranen, men når de er små, kan de 'lekke' ut. Kan den lekkasjen tjene et formål? Følg med på AAC-truck styringen:
Inne i mitokondrion, som rapportert her før , er det indre og ytre membraner, med TIM- og TOM-transportører som kontrollerer hva som kommer inn og kommer ut. I en annen artikkel i Nature , Bertholet et al. fant ut at AAC-transportproteiner har mer å gjøre enn bare å levere varer -her. De hjelper faktisk med å regulere hvor mange produkter som blir laget. Husk på følgende at H+ er et proton, 'drivstoffet' i proton-bevegelses kraften som driver F0 rotasjon i ATP-syntase. Protoner er ment å holde seg i den indre mitokondrielle membranen, men når de er små, kan de 'lekke' ut. Kan den lekkasjen tjene et formål? Følg med på AAC-truck styringen:
--Her registrerer vi AAC-strømmer direkte fra indre mitokondrielle membraner fra forskjellige musevev og identifiserer to distinkte transport modus: ADP/ATP-utveksling og H+ transport. Den AAC-medierte H+ -strømmen krever frie fettsyrer og ligner H+ -lekkasjen via det termogene frakoblingsproteinet 1 som finnes i brunt fett. ADP/ATP-utvekslingen via AAC regulerer H+ -lekkasjen på negativt vis, men hemmer den ikke fullstendig. Dette antyder at H+ -lekkasjen og mitokondriell frakobling kan kontrolleres dynamisk av cellulært ATP-behov og hastigheten på ADP/ATP-utveksling. Ved å formidle to distinkte transportformer , ADP/ATP-utveksling og H+ lekkasje, forbinder AAC koblet (ATP-produksjon) og frakoblet (termogenese) energiomsetning i mitokondrier.
Oversettelsen av dette til en mer hverdagslig analogi, holder AAC-lastebilsjåføren øye med hvor mange protoner som lekker ut i cytoplasmaet, og ringer tilbake til motorhuset for å få dem til å senke produksjonen. Når truckføreren kan følge med i produksjonen, er protonlekkasje liten (negativ regulering). Men når flere protoner lekker ut, advarer sjåføren om at ATP-syntase overgår etterspørselen.
Mer komplisert som vanlig
Det er faktisk mer komplisert enn dette, som vanlig. Protonlekkasje (IH) styres av et annet protein, Frakoblings-protein #1 (UCP1), som regulerer protoner som krysser den indre mitokondrielle membranen. Dette proteinet fungerer i samarbeid med AAC, som gjør jobben med å levere ATP til cytosol eller bringe ADP tilbake. Resultatet er en annen 'mester'-lig løsning for 'delikat' -å regulere mengden av ATP-produksjon.
 --Med AAC er IH negativt regulert av ADP/ATP-utveksling, mens med UCP1, blir IH ganske enkelt hemmet av cytosolske adenin-nukleotider. Denne muligheten til å justere IH dynamisk i samsvar med ADP/ATP-utveksling (og dermed cellulær ATP-etterspørsel) kan gjøre AAC unikt egnet til å være UCP for mitokondrier som spesialiserer seg i ATP-produksjon. Dermed ser AAC ut til å fungere som en masterregulator for mitokondriell energiutgang, og opprettholde en delikat balanse mellom ATP-produksjon og termogenese.
--Med AAC er IH negativt regulert av ADP/ATP-utveksling, mens med UCP1, blir IH ganske enkelt hemmet av cytosolske adenin-nukleotider. Denne muligheten til å justere IH dynamisk i samsvar med ADP/ATP-utveksling (og dermed cellulær ATP-etterspørsel) kan gjøre AAC unikt egnet til å være UCP for mitokondrier som spesialiserer seg i ATP-produksjon. Dermed ser AAC ut til å fungere som en masterregulator for mitokondriell energiutgang, og opprettholde en delikat balanse mellom ATP-produksjon og termogenese.
Flere detaljer, mer finjustering
Etter hvert som flere detaljer om ATP-syntase -her kommer fram, vises mer og mer finjustering. Syntesen av ATP, som var nødvendig helt fra starten av metabolsk levetid, blir nå sett på som å være fenomenalt effektiv og mesterlig regulert av flere deler som arbeider sammen. Bare gi sjanser milliarder av år, og mirakler som dette kan skje. Nettopp ikke.

Oversettelse og bilder ved Asbjørn E. Lund
 Design for ATP strekker seg utover rotasjonsmotoren
Design for ATP strekker seg utover rotasjonsmotoren Design for ATP strekker seg utover rotasjonsmotoren
Design for ATP strekker seg utover rotasjonsmotoren --F1 -ATPase er et lite motor protein, sammensatt av 3 alpha- og 3 beta -underenheter som omgir en sentral gamma -underenhet. P-underenhetene veksler syklisk mellom to hovedkonformasjons-tilstander for å produsere rotasjonen til y-underenheten. Selv om rotasjonen på mikrosekunds tidsskala drives av den differensielle bindingen av ATP og dens hydrolyseprodukter ADP og
--F1 -ATPase er et lite motor protein, sammensatt av 3 alpha- og 3 beta -underenheter som omgir en sentral gamma -underenhet. P-underenhetene veksler syklisk mellom to hovedkonformasjons-tilstander for å produsere rotasjonen til y-underenheten. Selv om rotasjonen på mikrosekunds tidsskala drives av den differensielle bindingen av ATP og dens hydrolyseprodukter ADP og  konformasjonsendringer i proteindelene og frigjøring av produkter som driver rotasjon av rotoren. Elastisiteten eller 'stivheten' i rotoren bidrar også til effektiv energiomsetning. Så finstemt er hver del av motoren i forhold til de andre, at den frie energien 'endres lineært langs rotasjonskoordinaten.' Dette betyr at motoren 'fungerer nær maksimal mulig effektivitet.'
konformasjonsendringer i proteindelene og frigjøring av produkter som driver rotasjon av rotoren. Elastisiteten eller 'stivheten' i rotoren bidrar også til effektiv energiomsetning. Så finstemt er hver del av motoren i forhold til de andre, at den frie energien 'endres lineært langs rotasjonskoordinaten.' Dette betyr at motoren 'fungerer nær maksimal mulig effektivitet.' Den første artikkelen dreide seg først og fremst om F1-delen av ATP-syntase, der ATP-syntese eller hydrolyse forekommer. F0- delen, der protoner driver rotasjon av et karuselllignende hjul, bidrar også til effektiviteten. Den driver y-underenheten som fungerer som en kamaksel. Akselen strekker seg inn i F1- delen, og 'snapper' effektivt ADP og fosfat sammen for å danne ATP i tre trinn per omdreining: syntese, utstøting og lastning. Et papir av Murphy et al. i Nature-her utforsker fleksibiliteten i y-underenheten som bidrar til effektiviteten i denne 'velsmurte maskinen'.
Den første artikkelen dreide seg først og fremst om F1-delen av ATP-syntase, der ATP-syntese eller hydrolyse forekommer. F0- delen, der protoner driver rotasjon av et karuselllignende hjul, bidrar også til effektiviteten. Den driver y-underenheten som fungerer som en kamaksel. Akselen strekker seg inn i F1- delen, og 'snapper' effektivt ADP og fosfat sammen for å danne ATP i tre trinn per omdreining: syntese, utstøting og lastning. Et papir av Murphy et al. i Nature-her utforsker fleksibiliteten i y-underenheten som bidrar til effektiviteten i denne 'velsmurte maskinen'. Vi finner at F 1- hodet roterer sammen med den sentrale stangen og c-ringen gjennom omtrent 30
Vi finner at F 1- hodet roterer sammen med den sentrale stangen og c-ringen gjennom omtrent 30 Inne i mitokondrion, som rapportert her før , er det indre og ytre membraner, med TIM- og TOM-transportører som kontrollerer hva som kommer inn og kommer ut. I en annen artikkel i Nature , Bertholet et al. fant ut at AAC-transportproteiner har mer å gjøre enn bare å levere varer -her. De hjelper faktisk med å regulere hvor mange produkter som blir laget. Husk på følgende at H+ er et proton, 'drivstoffet' i proton-bevegelses kraften som driver F0 rotasjon i ATP-syntase. Protoner er ment å holde seg i den indre mitokondrielle membranen, men når de er små, kan de 'lekke' ut. Kan den lekkasjen tjene et formål? Følg med på AAC-truck styringen:
Inne i mitokondrion, som rapportert her før , er det indre og ytre membraner, med TIM- og TOM-transportører som kontrollerer hva som kommer inn og kommer ut. I en annen artikkel i Nature , Bertholet et al. fant ut at AAC-transportproteiner har mer å gjøre enn bare å levere varer -her. De hjelper faktisk med å regulere hvor mange produkter som blir laget. Husk på følgende at H+ er et proton, 'drivstoffet' i proton-bevegelses kraften som driver F0 rotasjon i ATP-syntase. Protoner er ment å holde seg i den indre mitokondrielle membranen, men når de er små, kan de 'lekke' ut. Kan den lekkasjen tjene et formål? Følg med på AAC-truck styringen: --Med AAC er IH negativt regulert av ADP/ATP-utveksling, mens med UCP1, blir IH ganske enkelt hemmet av cytosolske adenin-nukleotider. Denne muligheten til å justere IH dynamisk i samsvar med ADP/ATP-utveksling (og dermed cellulær ATP-etterspørsel) kan gjøre AAC unikt egnet til å være UCP for mitokondrier som spesialiserer seg i ATP-produksjon. Dermed ser AAC ut til å fungere som en masterregulator for mitokondriell energiutgang, og opprettholde en delikat balanse mellom ATP-produksjon og termogenese.
--Med AAC er IH negativt regulert av ADP/ATP-utveksling, mens med UCP1, blir IH ganske enkelt hemmet av cytosolske adenin-nukleotider. Denne muligheten til å justere IH dynamisk i samsvar med ADP/ATP-utveksling (og dermed cellulær ATP-etterspørsel) kan gjøre AAC unikt egnet til å være UCP for mitokondrier som spesialiserer seg i ATP-produksjon. Dermed ser AAC ut til å fungere som en masterregulator for mitokondriell energiutgang, og opprettholde en delikat balanse mellom ATP-produksjon og termogenese.